Veikliosios medžiagos: tafluprostas
SAFLUTAN 15 mikrogramų / ml akių lašai, tirpalas
Kodėl naudojamas Saflutanas? Kam tai?
Kokio tipo vaistas yra ir kaip jis veikia?
SAFLUTAN akių lašuose yra tafluprosto, kuris priklauso vaistų, vadinamų prostaglandinų analogais, grupei.SAFLUTAN sumažina spaudimą akies viduje. Jis naudojamas, kai spaudimas akies viduje yra per didelis.
Kam vartojamas šis vaistas?
SAFLUTAN vartojamas glaukomos tipui, vadinamam atviro kampo glaukoma, gydyti, taip pat suaugusiųjų akių hipertenzijai gydyti. Abi sąlygos yra susijusios su padidėjusiu akispūdžiu ir ilgainiui gali sutrikdyti regėjimą.
Kontraindikacijos Kai Saflutan vartoti negalima
SAFLUTAN vartoti negalima, jeigu yra alergija tafluprostui arba bet kuriai pagalbinei šio vaisto medžiagai (jos išvardytos 6 skyriuje).
Atsargumo priemonės Vartojant prieš vartojant Saflutan
Pasitarkite su gydytoju, vaistininku arba slaugytoja, prieš pradėdami vartoti SAFLUTAN
Atminkite, kad SAFLUTAN gali turėti tokį poveikį, kai kurie iš jų gali būti nuolatiniai:
- SAFLUTAN gali padidinti blakstienų ilgį, storį, spalvą ir (arba) skaičių ir sukelti neįprastą plaukų augimą ant vokų.
- SAFLUTAN gali patamsinti odą aplink akis. Pašalinkite tirpalo likučius iš odos. Tai sumažins odos patamsėjimo riziką.
- SAFLUTAN gali pakeisti rainelės spalvą (spalvotą akies dalį). Jei SAFLUTAN vartojama vienoje akyje, gydomos akies spalva gali visam laikui skirtis nuo kitos akies spalvos.
Pasakykite gydytojui
- jeigu sergate inkstų liga
- jeigu sergate kepenų liga
- jeigu sergate astma
- jeigu sergate kitomis akių ligomis.
Vaikai ir paaugliai
SAFLUTAN nerekomenduojama vartoti vaikams ir jaunesniems kaip 18 metų paaugliams, nes trūksta duomenų apie saugumą ir veiksmingumą.
Sąveika Kokie vaistai ar maistas gali pakeisti saflutano poveikį
Jeigu vartojate arba neseniai vartojote kitų vaistų arba dėl to nesate tikri, apie tai pasakykite gydytojui arba vaistininkui.
Jei vartojate kitus vaistus į akis, palaukite mažiausiai 5 minutes nuo SAFLUTAN vartojimo iki kito vaisto vartojimo.
Įspėjimai Svarbu žinoti, kad:
Nėštumas, žindymo laikotarpis ir vaisingumas
Jei galite pastoti, gydymo SAFLUTAN metu turite naudoti veiksmingą kontracepcijos metodą. Jei esate nėščia, SAFLUTAN vartoti negalima. Žindymo laikotarpiu SAFLUTAN vartoti negalima.
Klauskite gydytojo patarimo.
Vairavimas ir mechanizmų valdymas
SAFLUTAN neturi įtakos gebėjimui vairuoti ir valdyti mechanizmus. Po SAFLUTAN vartojimo gali atsirasti trumpalaikis regėjimo sutrikimas. Nevairuokite ir nevaldykite įrankių ar mechanizmų, kol jūsų regėjimas vėl nėra aiškus.
Svarbi informacija apie kai kurias pagalbines SAFLUTAN medžiagas
SAFLUTAN sudėtyje yra benzalkonio chlorido. Benzalkonio chloridas gali dirginti akis.
Kontaktiniai lęšiai
Žinoma, kad benzalkonio chloridas pakeičia minkštųjų kontaktinių lęšių spalvą. Todėl venkite kontakto su minkštais kontaktiniais lęšiais.
Prieš uždėdami kontaktinius lęšius, išimkite juos ir palaukite bent 15 minučių, kol vėl uždėsite.
Dozė, vartojimo būdas ir laikas Kaip vartoti Saflutan: Dozavimas
Visada vartokite šį vaistą tiksliai kaip nurodė gydytojas arba vaistininkas. Jei abejojate, pasitarkite su gydytoju arba vaistininku.
Rekomenduojama dozė yra 1 lašas SAFLUTAN į kiekvieną gydomą akį vieną kartą per dieną vakare. Nedėkite daugiau lašų ir nevartokite vaisto dažniau, nei nurodė gydytojas. Tai gali sumažinti SAFLUTAN veiksmingumą.
Naudokite SAFLUTAN į abi akis tik tuo atveju, jei taip paskyrė gydytojas. Naudoti tik kaip akių lašus. Nenuryti.
Naudojimo instrukcijos:
Pradėdami naują buteliuką:
Nenaudokite buteliuko, jei nėra dangtelio ir kaklo dengiančios plastikinės plėvelės arba ji nepažeista. Nuimkite plastikinę plėvelę. Ant išorinės dėžutės esančioje vietoje užrašykite buteliuko atidarymo datą.
Kai vartojate SAFLUTAN
- Nusiplauk savo rankas.
- Atidarykite buteliuką. Būkite ypač atsargūs, kad lašintuvo buteliuko galiukas neliestų jūsų akies, odos aplink akį ar pirštų.
- Pakreipkite galvą atgal ir apverskite buteliuką aukštyn kojomis ant akies.
- Patraukite apatinį voką žemyn ir žiūrite aukštyn. Lengvai paspauskite buteliuką, kad lašas akių lašų patektų į tarpą tarp apatinio voko ir akies
- Akimirką užmerkite akis ir pirštu maždaug minutę paspauskite vidinį akies kampą.Tai padeda išvengti akių lašų tekėjimo per ašarų kanalą.
- Pašalinkite tirpalo likučius ant odos aplink akis.
- Uždėkite dangtelį ir sandariai uždarykite buteliuką.
Jei lašas nepatenka į akį, pakartokite operaciją.
Jei gydytojas nurodė lašinti lašus į abi akis, pakartokite 3–7 veiksmus kitai akiai.
Jei ant akių tepate kitus vaistus, palaukite mažiausiai 5 minutes nuo SAFLUTAN vartojimo iki kito vaisto vartojimo.
Pamiršus pavartoti SAFLUTAN, įlašinkite vieną lašą, kai tik prisiminsite, ir grįžkite prie įprasto dozavimo laiko. Negalima vartoti dvigubos dozės norint kompensuoti praleistą dozę.
Nenutraukite SAFLUTAN vartojimo nepasitarę su gydytoju. Nustojus vartoti SAFLUTAN, akispūdis vėl pakils. Tai gali sukelti nuolatinį akies pažeidimą.
Jeigu kiltų daugiau klausimų dėl šio vaisto vartojimo, kreipkitės į gydytoją, vaistininką arba slaugytoją.
Perdozavimas Ką daryti pavartojus per didelę Saflutan dozę
Jei pavartosite daugiau SAFLUTAN, nei nurodyta, vargu ar tai sukels rimtų pasekmių. Kitą dozę naudokite įprastu laiku.
Jei netyčia nurijote vaisto, kreipkitės į gydytoją patarimo.
Šalutinis poveikis Koks yra Saflutano šalutinis poveikis
Šis vaistas, kaip ir visi kiti, gali sukelti šalutinį poveikį, nors jis pasireiškia ne visiems žmonėms. Dauguma šalutinių poveikių nėra rimti.
Labai dažnas šalutinis poveikis
Šis poveikis gali pasireikšti daugiau kaip 1 iš 10 žmonių:
Poveikis akims:
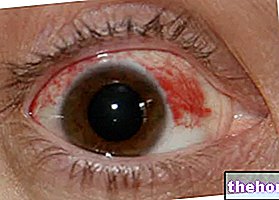
- akies paraudimas.
Dažnas šalutinis poveikis
Šis poveikis gali pasireikšti ne daugiau kaip 1 iš 10 žmonių:
Poveikis nervų sistemai:
- galvos skausmas
Poveikis akims:
- niežti akis
- akių dirginimas
- skausmas akyje
- blakstienų ilgio, storio ir skaičiaus pokyčiai
- sausa akis
- svetimkūnio pojūtis akyje
- blakstienų spalvos pasikeitimas
- akių vokų paraudimas
- nedideli uždegimo plotai akies paviršiuje
- jautrumas šviesai
- padidėjęs ašarojimas
- neryškus matymas
- sumažėjęs akies gebėjimas atskirti detales
- rainelės spalvos pasikeitimas (gali būti nuolatinis)
Nedažnas šalutinis poveikis
Šis poveikis gali pasireikšti ne daugiau kaip 1 iš 100 žmonių:
Poveikis akims:
- odos spalvos pasikeitimas aplink akis
- patinę vokai
- pavargusios akys
- akies paviršiaus membranų patinimas
- akių išskyros
- vokų uždegimas
- uždegimo požymiai akies viduje
- diskomfortas akyse
- akies paviršiaus membranų pigmentacija
- folikulai akies paviršinėse membranose
- alerginis uždegimas
- nenormalus pojūtis akyje
Poveikis odai ir poodiniam audiniui:
- neįprastas plaukų augimas ant vokų.
Dažnis nežinomas: negali būti įvertintas pagal turimus duomenis
Poveikis akims:
- rainelės / uvea (vidurinio akies sluoksnio) uždegimas
- akys, kurios atrodo nuskendusios
Poveikis kvėpavimo sistemai:
- astmos pablogėjimas, dusulys
Labai retais atvejais kai kuriems pacientams, kuriems buvo labai pažeistas skaidrus akies priekinės dalies sluoksnis (ragena), dėl gydymo metu ragenoje atsirado drumzlinų dėmių.
Pranešimas apie šalutinį poveikį
Jeigu pasireiškė šalutinis poveikis (net jeigu jis šiame lapelyje nenurodytas), kreipkitės į gydytoją, vaistininką arba slaugytoją. Apie šalutinį poveikį taip pat galite pranešti tiesiogiai naudodamiesi nacionaline pranešimo sistema, adresu www.agenziafarmaco.gov. It / it / atsakingas. Pranešdami apie šalutinį poveikį galite padėti gauti daugiau informacijos apie šio vaisto saugumą.
Galiojimo laikas ir išlaikymas
Šį vaistą laikykite vaikams nepastebimoje ir nepasiekiamoje vietoje.
Ant buteliuko etiketės ir dėžutės po „Tinka iki“ nurodytam tinkamumo laikui pasibaigus, šio vaisto vartoti negalima. Vaistas tinkamas vartoti iki paskutinės mėnesio dienos.
Laikyti ne aukštesnėje kaip 25 ° C temperatūroje.
Laikyti originalioje pakuotėje.
Kad išvengtumėte infekcijų, buteliuką išmeskite praėjus 28 dienoms po pirmojo atidarymo ir naudokite naują.
Nemeskite vaistų į kanalizaciją ar buitines atliekas. Paklauskite vaistininko, kaip išmesti nebenaudojamus vaistus. Tai padės apsaugoti aplinką.
Terminas "> Kita informacija
SAFLUTAN sudėtis
- Veiklioji medžiaga yra tafluprostas. 1 ml tirpalo yra 15 mikrogramų tafluprosto. Viename buteliuke (2,5 ml) akių lašų tirpalo yra 37,5 mikrogramo tafluprosto.
- Pagalbinės medžiagos yra benzalkonio chloridas (konservantas), glicerolis, natrio divandenilio fosfatas dihidratas, dinatrio edetatas, polisorbatas 80 ir injekcinis vanduo. Norint sureguliuoti pH, pridedama druskos rūgšties ir (arba) natrio hidroksido.
SAFLUTAN išvaizda ir pakuotės turinys
SAFLUTAN yra skaidrus ir bespalvis skystis (tirpalas), tiekiamas pakuotėje po 1 arba 3 skaidrius plastikinius butelius, kiekviename yra 2,5 ml tirpalo.
Plastikiniai buteliai uždaromi užsukamu dangteliu.
Gali būti tiekiamos ne visų dydžių pakuotės.
Šaltinio pakuotės lapelis: AIFA (Italijos vaistų agentūra). Turinys paskelbtas 2016 m. Sausio mėn. Pateikta informacija gali būti neatnaujinta.
Norint pasiekti naujausią versiją, patartina apsilankyti AIFA (Italijos vaistų agentūra) svetainėje. Atsisakymas ir naudinga informacija.
01.0 VAISTINIO PREPARATO PAVADINIMAS -
SAFLUTAN 15 mikrogramų / ml akių lašai, tirpalas
02.0 KOKYBINĖ IR KIEKYBINĖ SUDĖTIS -
Viename ml akių lašų tirpalo yra 15 mikrogramų tafluprosto.
Viename buteliuke (2,5 ml) akių lašų tirpalo yra 37,5 mcg tafluprosto.
Pagalbinė medžiaga: 0,1 mg benzalkonio chlorido 1 ml akių lašų, tirpalo.
Išsamų pagalbinių medžiagų sąrašą žr. 6.1 skyriuje.
03.0 FARMACINĖ FORMA -
Akių lašai, tirpalas (akių lašai).
Skaidrus ir bespalvis tirpalas.
04.0 KLINIKINĖ INFORMACIJA -
04.1 Terapinės indikacijos
Padidėjusio akispūdžio sumažėjimas esant atviro kampo glaukomai ir akių hipertenzijai.
Kaip monoterapija pacientams
• kurie nepakankamai reagavo į pirmosios eilės gydymą
• kurie netoleruoja arba kuriems pirmosios eilės gydymas yra kontraindikuotinas
Kaip papildomas gydymas beta adrenoblokatoriams.
SAFLUTAN skirtas suaugusiesiems, vyresniems nei 18 metų.
04.2 Dozavimas ir vartojimo metodas
Dozavimas
Rekomenduojama dozė yra vienas lašas SAFLUTAN į pažeistos akies (-ių) junginės maišelį vieną kartą per dieną, vakare.
Dozė neturi viršyti vienos paros dozės, nes dažniau vartojant gali sumažėti hipotenzinis poveikis akispūdžiui.
Vartojimas senyviems žmonėms:
Senyviems pacientams dozės koreguoti nereikia.
Vaikų populiacija:
Tafluprosto saugumas ir veiksmingumas vaikams iki 18 metų dar nėra nustatytas.
Vartojimas esant inkstų / kepenų funkcijos sutrikimui
Tafluprosto poveikis pacientams, kurių inkstų ar kepenų funkcija sutrikusi, netirtas, todėl šiems pacientams jo reikia vartoti atsargiai.
Vartojimo metodas
Kad išvengtumėte galimo tirpalo užteršimo, pacientai neturėtų liesti akių vokų, aplinkinių sričių ar bet kokio kito paviršiaus buteliuko aplikatoriaus antgaliu.
Kad sumažėtų akių vokų odos patamsėjimo rizika, pacientai turi nuvalyti nuo odos likusį tirpalą. Kaip ir vartojant bet kokius kitus akių lašus, po vaisto vartojimo rekomenduojama užkimšti nosies ertmę arba švelniai uždaryti voką, nes tai gali sumažinti sisteminę akių vaistų absorbciją.
Jei naudojamas daugiau nei vienas vietinis oftalmologinis vaistas, tarp kiekvieno vaistinio preparato reikia skirti mažiausiai 5 minučių pertrauką.
04.3 Kontraindikacijos -
Padidėjęs jautrumas veikliajai medžiagai tafluprostui arba bet kuriai 6.1 skyriuje nurodytai pagalbinei medžiagai.
04.4 Specialūs įspėjimai ir atsargumo priemonės
Prieš pradedant gydymą, pacientus reikia informuoti apie blakstienų pailgėjimo, akių vokų odos patamsėjimo ir rainelės pigmentacijos padidėjimo galimybę. Kai kurie iš šių pokyčių gali būti nuolatiniai ir gali sukelti skirtumų tarp dviejų akių tik vieno atveju akis gydoma.
Rainelės pigmentacijos pokyčiai vyksta lėtai ir gali būti nepastebimi kelis mėnesius.Kitą akių spalva pakeitė daugiausia pacientai, turintys mišrios spalvos rainelės, pavyzdžiui, melsvai rudos, pilkai rudos, geltonai rudos ir žaliai rudos. Vienašališko gydymo atvejais akivaizdi nuolatinės heterochromijos rizika.
Tafluprosto vartojimo pacientams, sergantiems neovaskuline, siauro kampo, siauro kampo ar įgimta glaukoma, patirties nėra. Tafluprosto vartojimo pacientams, sergantiems afakija ir pigmentine ar pseudoeksfoliacine glaukoma, patirties yra nedaug.
Tafluprosto patariama vartoti atsargiai pacientams, sergantiems afakija, pseudofakija, kuriems yra plyšusi užpakalinė lęšio kapsulė arba priekinės kameros lęšiai, arba pacientams, kuriems yra žinomų cistinės geltonosios dėmės edemos ar irito / uveito rizikos veiksnių.
Pacientų, sergančių sunkia astma, patirties nėra, todėl tokius pacientus reikia gydyti atsargiai.
Buvo pranešta, kad benzalkonio chloridas, dažniausiai naudojamas kaip konservantas oftalmologiniuose produktuose, sukelia taškinę keratopatiją ir (arba) toksinę opinę keratopatiją. Kadangi SAFLUTAN sudėtyje yra benzalkonio chlorido, dažnai ar ilgai vartojant pacientus, kuriems yra sausa akis, arba esant ragenos pažeidimui, reikia atidžiai stebėti.
SAFLUTAN sudėtyje yra benzalkonio chlorido, kuris gali dirginti akis. Venkite kontakto su minkštais kontaktiniais lęšiais. Prieš įdėdami kontaktinius lęšius, išimkite juos ir palaukite bent 15 minučių, kol įdėsite juos atgal. Žinoma, kad benzalkonio chloridas pakeičia minkštųjų kontaktinių lęšių spalvą.
04.5 Sąveika su kitais vaistiniais preparatais ir kitos sąveikos formos
Sąveikos žmonėms nesitikima, nes sisteminė tafluprosto koncentracija po akių dozavimo yra labai maža, todėl specifinių sąveikos su kitais vaistiniais preparatais tyrimų su tafluprostu neatlikta.
Klinikinių tyrimų metu tafluprostas buvo vartojamas kartu su timololiu be sąveikos požymių.
04.6 Nėštumas ir žindymo laikotarpis -
Vaisingo amžiaus moterys / kontracepcija
SAFLUTAN negalima vartoti vaisingoms moterims, nebent yra tinkamų kontracepcijos priemonių (žr. 5.3 skyrių).
Nėštumas
Nėra pakankamai duomenų apie tafluprosto vartojimą nėščioms moterims.
Tafluprostas gali turėti žalingą farmakologinį poveikį nėštumui ir (arba) vaisiui / naujagimiui.
Tyrimai su gyvūnais parodė toksinį poveikį reprodukcijai (žr. 5.3 skyrių). Todėl SAFLUTAN nėštumo metu vartoti negalima, nebent tai yra absoliučiai būtina (jei nėra kitų gydymo būdų).
Maitinimo laikas
Nežinoma, ar tafluprosto ar jo metabolitų patenka į motinos pieną. Tyrimas su žiurkėmis parodė, kad po vietinio vartojimo tafluprosto ir (arba) jo metabolitų išsiskiria į motinos pieną (žr. 5.3 skyrių).
Todėl žindymo laikotarpiu tafluprosto vartoti negalima.
Vaisingumas
Žiurkių patinams ir patelėms po 100 ml / kg per parą suleistos tafluprosto dozės neturėjo įtakos poravimosi gebėjimui ir vaisingumui.
04.7 Poveikis gebėjimui vairuoti ir valdyti mechanizmus -
Tafluprostas neturi įtakos gebėjimui vairuoti ir valdyti mechanizmus. Kaip ir bet kuris oftalmologinis gydymas, po įlašinimo laikui bėgant regėjimas tampa neryškus, prieš vairuodamas ar valdydamas mechanizmus pacientas turi palaukti, kol regėjimas išnyks.
04.8 Nepageidaujamas poveikis -
Klinikinių tyrimų metu daugiau nei 1400 pacientų buvo gydomi konservantu tafluprostu, monoterapija arba papildomai prie 0,5% timololio. Dažniausias su gydymu susijęs nepageidaujamas reiškinys buvo akių hiperemija. Tai atsitiko maždaug 13% pacientų, dalyvavusių klinikiniuose tyrimuose su konservantu tafluprostu Europoje ir JAV. Daugeliu atvejų šis reiškinys buvo lengvas ir nutraukė gydymą vidutiniškai 0,4% bandomuosiuose tyrimuose dalyvavusių pacientų. 3 mėnesius trukusiame III fazės tyrime, atliktame JAV, lyginant tafluprosto preparatą be konservantų su timololio preparatu be konservantų, akių hiperemija pasireiškė 4,1% (13/320) pacientų, gydytų tafluprostu.
Klinikinių tafluprosto tyrimų metu Europoje ir JAV po ilgiausio 24 mėnesių stebėjimo buvo pastebėtas toks su gydymu susijęs nepageidaujamas poveikis:
Kiekvienoje dažnio klasėje nepageidaujamas poveikis nurodomas mažėjančia dažnio tvarka.
Nervų sistemos sutrikimai
Dažni (≥1 / 100, galvos skausmas)
Akių sutrikimai
Labai dažni (≥1 / 10): junginės / akių hiperemija
Dažni (≥1 / 100, akių niežėjimas, akių sudirginimas, akių skausmas, blakstienų pakitimai (ilgio, storio ir skaičiaus padidėjimas), akių sausumas, svetimkūnio pojūtis akyje, blakstienų spalvos pasikeitimas, vokų eritema, paviršinis keratitas (CPS) , fotofobija, padidėjęs ašarojimas, neryškus matymas, sumažėjęs regėjimo aštrumas ir padidėjusi rainelės pigmentacija.
Nedažni (≥1 / 1 000, žandikaulių edema, astenopija, junginės edema, išskyros iš akių, blefaritas, ląstelių buvimas priekinėje kameroje, diskomfortas akyse, išsiplėtimas už priekinės kameros, junginės pigmentacija, junginės folikulai, alerginis konjunktyvitas ir nenormalūs pojūčiai į akis.
Dažnis nežinomas (negali būti apskaičiuotas pagal turimus duomenis): iritas / uveitas, vokų vagos gilėjimas.
Kai kuriems pacientams, kuriems buvo labai pažeista ragena, labai retai buvo pranešta apie ragenos kalcifikacijos atvejus, kai buvo naudojami akių lašai, kurių sudėtyje yra fosfatų.
Kvėpavimo sistemos patologijos
Dažnis nežinomas (negali būti įvertintas pagal turimus duomenis): astmos paūmėjimas, dusulys
Odos ir poodinio audinio sutrikimai
Nedažni (≥ 1/1 000, akių vokų hipertrichozė)
Pranešimas apie įtariamas nepageidaujamas reakcijas
Svarbu pranešti apie įtariamas nepageidaujamas reakcijas, atsiradusias po vaistinio preparato registravimo, nes tai leidžia nuolat stebėti vaisto naudos ir rizikos santykį. Sveikatos priežiūros specialistų prašoma pranešti apie bet kokias įtariamas nepageidaujamas reakcijas per nacionalinę pranešimo sistemą. "Adresas www. agenziafarmaco.gov.it/it/responsabili.
04.9 Perdozavimas -
Pavartojus į akis, perdozavimas mažai tikėtinas.
Perdozavus, gydymas turi būti simptominis.
05.0 FARMAKOLOGINĖS SAVYBĖS
05.1 "Farmakodinaminės savybės -
Farmakoterapinė grupė: antiglaukoma ir miotiniai preparatai, prostaglandinų analogai
ATC kodas: S01EE05
Veiksmo mechanizmas
Tafluprostas yra fluorintas prostaglandino F2α analogas. Tafluprosto rūgštis, biologiškai aktyvus tafluprosto metabolitas, yra labai stiprus ir selektyvus žmogaus prostanoidų FP receptorių agonistas. Tafluprosto rūgštis turi 12 kartų didesnį afinitetą FP receptoriams nei latanoprostas. Farmakodinaminiai tyrimai su beždžionėmis rodo, kad tafluprostas mažina akispūdį, didindamas vandeninio humoro nutekėjimą uveoskleraliniu būdu.
Farmakodinaminis poveikis
Eksperimentai su normotenzinėmis beždžionėmis ir beždžionėmis, sergančiomis akių hipertenzija, parodė, kad tafluprostas yra veiksmingas junginys, mažinantis akispūdį. Tyrime, kuriame buvo vertinamas tafluprosto metabolitų poveikis mažinant akispūdį, tik tafluprosto rūgštis žymiai sumažino akispūdį.
Triušiams, gydytiems 4 savaites tafluprosto 0,0015% oftalmologiniu tirpalu vieną kartą per parą, regos nervo galvos kraujotaka gerokai padidėjo (15%), palyginti su pradine verte, išmatuota lazerio dėmių srauto grafika 14 ir 28 dienomis.
Klinikinis veiksmingumas
Akispūdis mažėja praėjus 2–4 valandoms po pirmojo vartojimo, o didžiausias poveikis pasiekiamas praėjus maždaug 12 valandų po įlašinimo. Poveikio trukmė išlieka mažiausiai 24 valandas. Bandomieji tafluprosto preparatų, kurių sudėtyje yra konservanto benzalkonio chlorido, tyrimai parodė, kad tafluprostas yra veiksmingas atskirai ir turi papildomą poveikį vartojant kartu su timololiu: 6 mėnesių trukmės tyrimas parodė, kad tafluprosto poveikis akies spaudimui sumažėjo nuo 6 iki 8 mmHg skirtingu paros metu, palyginti su 7–9 mmHg, gautu vartojant latanoprosto. Antrojo 6 mėnesių klinikinio tyrimo metu tafluprostas sumažino akispūdį nuo 5 iki 7 mmHg, palyginti su 4–6 mmHg, gautu vartojant timololį. Tafluprosto akispūdį mažinantis poveikis išliko pratęsiant šiuos tyrimus iki 12 mėnesių. 6 mėnesius trukusio tyrimo metu sumažėjęs tafluprosto poveikis akispūdžiui slėgis buvo lyginamas su tirpiklio slėgiu, kai jis vartojamas kartu su timololiu. Papildomas akispūdį mažinantis poveikis, lyginant su pradinėmis vertėmis (išmatuotas po 4 timololio vartojimo savaičių), buvo 5–6 mmHg timololio-tafluprosto grupėje ir 3–4 mmHg tirpalo, vartojamo timololio, grupėje. Tafluprosto kompozicijos be konservantų ir be konservantų parodė panašų poveikį mažinant akispūdį virš 5 mmHg nedidelio kryžminio tyrimo metu, kurio trukmė buvo 4 savaitės. Be to, JAV atliktame 3 mėnesių tyrime, kuriame buvo lyginama tafluprosto formulė be konservantų ir be konservantų timololio, tafluprosto poveikis mažinant akispūdį skirtingo vertinimo metu buvo 6,2–7,4 mmHg. timololis svyravo nuo 5,3 iki 7,5 mmHg.
05.2 "Farmakokinetinės savybės -
Absorbcija
Vieną kartą per parą į akis įlašinus vieną lašą tafluprosto 0,0015% akių lašų į abi akis 8 dienas, tafluprosto rūgšties koncentracija plazmoje buvo maža ir buvo panaši į profilį 1 ir 8 dienomis. vieną valandą po dozavimo. žemiau vidutinės aptikimo slenksčio (10 pg / ml). Vidutinės Cmax vertės (24,4 ir 31,4 pg / ml) ir paskutinis AUC0 (405,9 ir 581,1 pg * min / ml) dienomis buvo panašios 1 ir 8, o tai rodo, kad per pirmąją akių vartojimo savaitę buvo pasiekta pastovi vaisto koncentracija. Statistiškai reikšmingų skirtumų tarp sisteminių biologinių prieinamumų tarp preparatų su konservantais ir be jų nerasta.
Tyrimo su triušiais metu tafluprosto absorbcija į vandeninį humoro sluoksnį buvo panaši po vienkartinio įlašinimo į akis 0,0015% oftalmologinio tafluprosto tirpalo su konservantu arba be jo.
Paskirstymas
Beždžionėms nepastebėta specifinio radioaktyviai pažymėto tafluprosto pasiskirstymo iridociliariniame kūne ar gyslainėje, įskaitant tinklainės pigmento epitelį; tai rodo mažą afinitetą melanino pigmentui. Viso organizmo autoradiografijos tyrimo metu žiurkėms nustatyta didžiausia radioaktyvumas buvo pastebėtas ragenoje, po to - akies vokai, skleros ir rainelė.
Rūgštinio tafluprosto prisijungimas prie žmogaus serumo albumino in vitro buvo 99%, esant 500 ng / ml rūgštinio tafluprosto.
Biotransformacija
Pagrindinis tafluprosto metabolizmo kelias žmonėms, kuris buvo išbandytas in vitrosusideda iš hidrolizės į farmakologiškai aktyvų metabolitą tafluprosto rūgštį, kuri toliau metabolizuojama gliukuronizacijos arba beta oksidacijos būdu. Beta oksidacijos produktai, 1,2-dinoras ir 1,2,3,4-tetranoro rūgštys, kurios yra farmakologiškai neaktyvūs, jie gali būti gliukuronizuoti arba hidroksilinti. Citochromo P450 (CYP) fermentų sistema nedalyvauja tafluprosto rūgšties metabolizme. Remiantis tyrimu su triušio ragenos audiniu ir išgrynintais fermentais, pagrindinė esterazė, atsakinga už esterio hidrolizę į tafluprosto rūgštis yra karboksilesterazė. Butilcholinesterazė, bet ne acetilcholinesterazė, taip pat gali prisidėti prie hidrolizės.
Eliminavimas
Vieną kartą per parą 21 dieną skiriant žiurkėms ³H-tafluprosto (0,005% oftalmologinio tirpalo; 5 mcl / akys) abiejose akyse, maždaug 87% visos radioaktyviosios dozės išsiskyrė su ekskrementais. Bendras išsiskyrimas su šlapimu buvo maždaug 27 -38% ir maždaug 44-58% dozės išsiskyrė su išmatomis.
05.3 Ikiklinikinių saugumo duomenys -
Įprastų farmakologinio saugumo, kartotinių dozių sisteminio toksiškumo, genotoksiškumo ir galimo kancerogeninio poveikio ikiklinikinių tyrimų duomenys nerodo jokio ypatingo pavojaus žmonėms. Kaip ir kitų PGF2 agonistų atveju, beždžionėms kartotinė vietinė tafluprosto dozė sukėlė negrįžtamą poveikį pigmentacijai rainelės ir grįžtamasis plačiaplėvės plyšio pločio padidėjimas.
„Padidėjęs gimdos susitraukimas in vitro Tafluprosto uterotoninis aktyvumas žmogaus gimdos preparatuose netirtas.
Toksinio poveikio reprodukcijai tyrimai su žiurkėmis ir triušiais buvo suleisti į veną. Žiurkėms nepastebėta jokio neigiamo poveikio vaisingumui ar ankstyvam embriono vystymuisi, kai sisteminė ekspozicija buvo didesnė nei 12 000 kartų didesnė už didžiausią klinikinę ekspoziciją, pagrįstą Cmax, arba didesnė nei 2200 kartų didesnė už AUC.
Įprastiniuose embriono ir vaisiaus vystymosi tyrimuose tafluprostas sumažino vaisiaus kūno svorį ir padidino nuostolius po implantacijos. Tafluprostas padidino žiurkių skeleto sutrikimų ir triušių kaukolės, smegenų ir stuburo apsigimimų dažnį. Triušių tyrimo metu tafluprosto ir jo metabolitų koncentracija plazmoje buvo mažesnė nei kiekybinė.
Prieš ir po gimdymo vystymosi žiurkių tyrime palikuonims, padidėjusiems tafluprosto dozėmis, didesnėmis nei klinikinė, buvo nustatytas padidėjęs naujagimių mirtingumas, sumažėjęs kūno svoris ir uždelstas ausų išsiplėtimas.
Eksperimentai su žiurkėmis su radioaktyviai pažymėtu tafluprostu parodė, kad maždaug 0,1% vietinės akies dozės pateko į pieną. Kadangi aktyvaus metabolito (tafluprosto rūgšties) pusinės eliminacijos laikas plazmoje yra labai trumpas (žmogaus neaptinkamas po 30 minučių), greičiausiai didžiąją radioaktyvumo dalį sukėlė metabolitai, kurių farmakologinis aktyvumas yra mažas arba jo nėra. Atsižvelgiant į vaisto ir natūralių prostaglandinų metabolizmą, tikimasi labai mažo geriamojo biologinio prieinamumo.
06.0 FARMACINĖ INFORMACIJA -
06.1 Pagalbinės medžiagos
Benzalkonio chloridas
Glicerolis
Natrio -vandenilio fosfato dihidratas
Dinatrio edetatas
Polisorbatas 80
Vandenilio chlorido rūgštis ir (arba) natrio hidroksidas (pH koreguoti)
Injekcinis vanduo
06.2 Nesuderinamumas "-
Nėra svarbus
06.3 Galiojimo laikas "-
3 metai.
Pirmą kartą atidarius buteliuką: 28 dienos.
06.4 Specialios laikymo sąlygos -
Laikyti ne aukštesnėje kaip 25 ° C temperatūroje.
Laikyti originalioje pakuotėje.
06.5 Pirminės pakuotės pobūdis ir pakuotės turinys -
Skaidrus polipropileno butelis su polipropileniniu lašintuvo antgaliu ir didelio tankio polietileno dangteliu. Kiekvieno buteliuko tūris yra 2,5 ml.
Galimos šių dydžių pakuotės: dėžutės, kuriose yra 1 arba 3 2,5 ml buteliukai.
Gali būti tiekiamos ne visų dydžių pakuotės.
06.6 Naudojimo ir naudojimo instrukcijos -
Nepanaudotą vaistą ir jo atliekas reikia sunaikinti laikantis vietinių taisyklių.
07.0 RINKODAROS TEISĖS TURĖTOJAS -
„MSD Italia S.r.l.“
Via Vitorchiano, 151 - 00189 Roma
08.0 RINKODAROS TEISĖS NUMERIS -
15 mcg / ml akių lašai, tirpalas
1 butelis 2,5 ml AIC n. 038926010
15 mcg / ml akių lašai, tirpalas
3 buteliukai po 2,5 ml AIC n. 038926022
09.0 RINKODAROS TEISĖS SUTEIKIMO AR PATVIRTINIMO DATA
Registravimo data: 2010 m. Gegužės mėn
Paskutinio atnaujinimo data: 2014 m. Vasaris
10.0 TEKSTO PERŽIŪROS DATA -
2014 lapkritis

















.jpg)